细胞生长曲线是测定细胞绝对生长数的常用方法,也是判定细胞活力的重要指标,是培养细胞生物学特性的基本参数之一。测定细胞的生长曲线方式有多种,利用细胞培养瓶进行计数是常用的一种方式。
通过测定生长曲线,可以测定细胞绝对生长数,判断细胞活力,可用于测定药物等外来因素对细胞生长的影响,有助于我们选择该时期的细胞进行细胞下游实验(瞬时转染或稳定转染)。
以下介绍细胞计数的主要方法和注意点
实验背景
生长曲线是细胞数量随培养时间而变化的曲线。培养细胞生长过程可分为几个阶段:潜伏期、指数生长期、停滞期也指平台期。
潜伏期(latent phase)
细胞接种后,先经过一个在培养液中呈悬浮状态的悬浮期.此时,细胞质回缩, 胞体呈圆球形。然后细胞贴附于载体表面,称贴壁,悬浮期结束。 细胞贴壁速度与细胞种类,培养基成分,载体的理化性质等密切相关。一般情况下,原代培养细胞贴壁速度慢,可达10-24 小时或更多,而传代细胞系贴壁速度快, 通常10-30 分钟即可贴壁。细胞贴壁后还需经过一个潜伏阶段,才进入生长和增殖期。原代培养细胞潜伏期长,约24-96 小时或更长,连续细胞系和肿瘤细胞潜伏期短,仅需6-24 小时。
(2) 指数增生期(logarithmic growth phase)
这是细胞增殖zui旺盛的阶段,分裂相细胞增多。指数增生期细胞分裂相数量可作为判定细胞生长是否旺盛的一个重要标志。通常以细胞分裂相指数(Mitotic index, MI)表示,即细胞群中每1000 个细胞中的分裂相数。一般细胞的分裂指数介于0.1%-0.5%,原代细胞分裂指数较低,而连续细胞和肿瘤细胞分裂相指数可高达3%-5%。指数增生期的细胞活力时期,是进行各种实验*时期,也是冻存细胞的时机。在接种细胞数量适宜情况下,指数增生期持续3-5 天后,随着细胞数量不断增多、生长空间减少,zui后细胞相互接触汇合成片。正常细胞相互接触后能抑制细胞运动,这种现象称接触抑制现象(contact inhibition)。而恶性肿瘤细胞无接触抑制现象,能继续移动和增殖,导致细胞向三维空间扩展,使细胞发生堆积(piled up)。细胞接触汇合成片后,虽然发生接触抑制,但只要营养充分,细胞仍能进行增殖分裂,因此细胞数仍然在增多。但是,当细胞密度进一步增大,培养液中营养成分减少,代谢产物增多时,细胞因营养枯竭和代谢产物的影响,导致细胞分裂停止,这种现象称密度抑制现象(Density Inhibition)。
(3)停滞期(Stagnate phase)
细胞数量达到饱和密度后,如不及时进行传代,细胞就会停止增殖,进入停止期。此时细胞数持平,故也称平台期(Plateau phase)。停滞期细胞虽不增殖,但仍有代谢活动。如不进行分离传代,细胞会因培养液中营养耗尽、代谢产物积聚、pH 下降等因素中毒,出现形态改变,贴壁细胞会脱落,严重的会发生死亡,因此,应及时传代。
实验原理
生长曲线的测定是测定细胞绝对生长数的常用方法,也是判定细胞活力的重要指标,是培养细胞生物学特性的基本参数之一。除使用计数法测定细胞的生长曲线外,还可以可以使用MTT比色法。其原理是:MTT被活细胞中的线粒体琥珀酸脱氢酶还原后,生成暗蓝色甲瓒(Formazan),甲瓒被助溶剂溶解后,可在酶标仪上于570nm处读取OD值,在一定范围内OD值与活细胞数量呈线性关系。因此,OD值可间接地反应活细胞的状态。接种培养细胞后每天定时去除细胞,惊喜MTT检测,可以得到细胞生长曲线。用MTT发可以检测某些药物作用下细胞生长活力的变化,静儿评价药物对细胞存货和生长的作用。测定细胞生长的另一个指标是有丝分裂指数,为计数1000个细胞中分裂细胞数,可以检测细胞增殖旺盛的程度。
实验准备
仪器:二氧化碳培养箱,显微镜,超净工作台,血球计数板
试剂:胰蛋白酶,培养基(血清)
实验操作
1.取生长良好的细胞,用胰蛋白酶消化,离心;
2.离心后去上清,加入新鲜适量的培养基重悬细胞,使之成为单细胞悬液;
3.按照一定的倍数稀释该单细胞悬液,稀释倍数以稀释结果细胞数在20-200之间为合适倍数;
4.准备血球计数板,洗净晾干;
5.吸取一定量的细胞悬液,加样到血球计数板上,显微镜下计数;
6.按照血球计数板的计数原理进行细胞计数;
7.计算细胞总数,调整细胞至一定浓度(1×105/ml)。细胞浓度=细胞计数板得到的细胞数量/4x稀释倍数x104/ml;
8.细胞再培养,准备24孔板,每孔中加入0.1ml的细胞(即1×104个细胞)和0.9ml的细胞培养基,轻轻晃动孔板(十字方向晃动),使细胞分布均匀,并进行常规细胞培养(48h后换液培养);
9.培养48h后,即可每过24h取样一次,每次取样至少取3个孔的细胞,多次计数取平均值,提高准确性,取样细胞常规胰蛋白酶消化,制备单细胞悬液,显微镜下进行细胞计数;
10.计数结果,以时间(d)为横坐标,细胞数为纵坐标,绘制细胞生长曲线。
结果分析
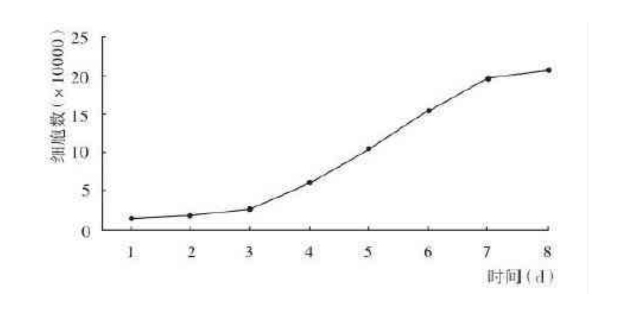
根据培养的时间和细胞计数的结果得到如下图,细胞培养初始几天生长缓慢,为延滞期。两到三天之后细胞进入对数生长期,此时细胞生长最为旺盛,细胞活力也相对最佳,通常在我们的细胞转染或构建稳定细胞系时选择对数生长期的细胞。一段时间后细胞进入稳定生长时期。
操作要点
细胞用胰蛋白酶消化,消化时间要自己把握,时间短细胞消化不好形成团状,时间长细胞死亡率可能会增加,制备成单细胞悬液即可
细胞计数时,按照计数原理数细胞,每个大方格中的细胞大于200小于20,则稀释倍数不适,需重新稀释。在消化细胞计数之前,可自己估算培养瓶中的总细胞数,这样可以预估下稀释的倍数,避免重新稀释
细胞接种时细胞摇均匀,接种按照十字方向晃动,晃动时间可以延长,以避免形成细胞团为准,但要防止细胞液溅出
细胞培养易被污染,污染原因也多种多样,实验室环境,细胞自身原因,如果为菌类污染建议丢弃重新复苏培养,更多相关情况及解决可参考资料专区细胞培养FAQ细胞计数法绘制生长曲线,操作相对简便。此外,MTT比色实验也能检测细胞的存活和生长,得到细胞生长曲线,且灵敏度高,重复性好,具体原理和操作见MTT法绘制生长曲线。
细胞计数及生长曲线测定常见问题
1.测定细胞生长曲线的意义是什么?
答:细胞生长曲线是测定细胞绝对生长数的常用方法,也是判定细胞活力的重要指标,是培养细胞生物学特性的基本参数之一。因为细胞太小,无法测单个细胞的生长状态,所以测细胞群体的生长曲线。
2. 如何选择细胞接种数?
答:可根据细胞传代培养过程中接种数及细胞生长周期进行计算,细胞接种数因细胞的不同而不同。
3.细胞计数时为什么要用台盼蓝染色?
答:加入台盼蓝后,活细胞不着色,台盼蓝着色的细胞呈深蓝色,是不健康或已死亡的细胞,不能计数。
4.细胞生长曲线测定时为什么要做重复孔?
答:测定细胞生长曲线细胞计数时选择 3 个复孔,每孔分别计三次,取其平均值,目的是减小操作误差。
5.细胞生长曲线测定周期是几天?
答:一般是一个星期。
6.为什么绘制的细胞生长曲线没有达到平台期?
答:可能有以下原因:一是细胞接种密度过低;二是细胞培养时间过短;三是细胞生长状态不好,使其不能正常增殖。
7.为什么细胞计数第一天,细胞数没有增加反而减少?
答:一般细胞传代后,会有一个生长缓慢的潜伏期,细胞不增殖,而细胞会有正常的死亡,故细胞数不增加反而减少。
8.细胞生长曲线还有其他方法绘制吗?
答:当然有。我们提到最多的是直接计数的方法,除此以外还有相对计数的方法,该类方法首先要绘制标准曲线,标定细胞数和某个变量的函数关系,然后我们只需要测定每天这个变量的值便可以计算出细胞数。常用的是 MTT、CCK8 等比色的方法。
相关问答
-
细胞名称:A7r5细胞系(A7R5大鼠胸大动脉平滑肌细胞)客户问题:细胞中黑色的是什么?原因分析:1.棉球纤维、凋亡细胞片、血清蛋白,或一些无血清培养基添加因子后的因子析出物,属于正常现象;2.如果是传代后细胞堆···...
阅读详情 -
细胞增殖速度怎么变得这么慢了?细胞发生病变,出现细胞变圆、从培养瓶壁脱落又是什么情况?要疯了,培养细胞怎么就这么难呢~实验过程中存在的“幽灵”,即使是经验丰富的老研究员也不得不面对,没错,它就是支原体感···...
阅读详情 -
胎牛血清和小牛血清的差别在哪里? 胎牛血清和小牛血清的差别在哪里? 胎牛血清(FBS) :从八月龄胎牛心脏穿刺取血。适用于专业的研究和试验,包括干细胞研究、免疫分析和抗体生产。 新生牛血青/小牛血清(NBCS) :从自出···...
阅读详情 -
适合细胞长期保存的温度是多少? 适合细胞长期保存的温度是多少? 细胞长期保存温度是-130°C或更低。液氮罐中气态层温度在-140°C至-180°C之间细胞可保存在气态层或浸入液氮中,如果可以最好保存在气态层,因为这样···...
阅读详情 -
如何在细胞铺板时避免“边缘效应”? 如何在细胞铺板时避免“边缘效应”? 以下这三点一定要注意!细胞实验铺板时,为避免“边缘效应”,以应用96孔板的中间60孔为最佳,一般四周的一圈边缘孔不养细胞,只做空白或阴性···...
阅读详情 -
如何收获需要冻存的细胞?最佳是什么时候?如何收获需要冻存的细胞?最佳是什么时候?用来冻存的细胞一般选择在细胞约铺满90%的时候,这时细胞生长状态好,细胞数量也多并且在收获细胞前24小时换一次培养液。收获用来冻···...
阅读详情