写在前面
今天推荐的是由首尔国立大学医学院在1995年发表于International Journal of Cancer的一篇文章(Q1,7.314),通讯作者是Jae-Gahb Parki。
摘要部分
研究人员鉴定了8株从韩国人原发性肿瘤中建立的人肝癌细胞系。 大多数培养的细胞保持了它们所衍生的原始肿瘤的许多形态学特征。 倍增时间为34~72小时。 所有品系均表现出较高的生活力,且未被支原体或细菌污染。 所有品系均为非整倍体,经DNA图谱分析证实为单倍体。 乙型肝炎病毒(HBV)DNA整合在所有品系的基因组中。 其中两株细胞系(SNU-354、SNU-368)表达HBV和HBVX(HBX)转录物。 Snu-354强表达白蛋白,Snu-368表达转铁蛋白和胰岛素样生长因子II。 没有一个品系在RNA和蛋白质水平上产生甲胎蛋白。 这些细胞系为肝癌相关的体外研究提供了有用的工具。本文报道了8个新建立的肝癌细胞LINCs(SNU-182、354、368、387、398、423、449和475)的特性。 测定细胞系表型,包括形态学和体外生长特性。 研究人员对HBV病毒转录本、甲胎蛋白(AFP)、白蛋白和转铁蛋白(TF)进行了分子鉴定,包括DNA指纹图谱分析和RNA表达。 同时检测胰岛素样生长因子I1(IGF-11)的RNA表达。
研究背景
肺肝细胞癌(HCC)是世界上最常见的胃肠道恶性肿瘤之一,每年约有100万人因此死亡。 尽管有流行病学和实验证据表明黄曲霉毒素等多种化学致癌物与HCC有关,但持续性乙型肝炎病毒(HBV)感染一直被认为是HCC的主要病因,占全球HCC的80%(Biscegli et al.1988)。 通过将克隆的病毒DNA转染到永生化细胞系或使用HBV转基因小鼠来研究HBV在肝癌发生中的作用。 另一种方法是使用整合HBV DNA的肝癌细胞系。 虽然从肝癌衍生的永久性细胞系将扩大肝癌发生研究的范围,但只有少数细胞系可用于研究。 此外,由于碘油和化疗药物的介入治疗,肝癌细胞系的建立越来越少。 术前应用这些治疗方法会导致肿瘤组织广泛坏死,在手术时只留下少量可共培养的存活肿瘤细胞。
研究材料方法
1. 细胞培养
细胞系是从病理证实的肝癌中建立的。 实体瘤用剪刀细小切碎,移液分离成小团聚体。 取适量的细小肿瘤组织碎片接种于25cmz烧瓶中。 肿瘤细胞在添加5%热灭活胎牛血清(AR5)的ACL-4培养基中初步培养。 ACL-4是一种完全定义的培养基,用于人肺腺癌的选择性生长,并已证明可用于建立结直肠细胞系。 ACL-4的组成包括RPMI 1640为基础培养基,胰岛素(20 pg/ml)、转铁蛋白(10 pGIml)、亚硒酸钠(25 nm)、氢化可的松(50 nm)、表皮生长因子(1 ng/ml)、乙醇胺(10 pm)、磷酰乙醇胺(10 pm)、三碘甲状腺原氨酸(100 pm)、牛血清白蛋白(2 mg/ml)、Hepes缓冲液(10 mm)、谷氨酰胺(2 mm)和丙酮酸钠(0.5 mm)。 RPMI1640、谷氨酰胺和丙酮酸钠从GIBCO/BRL)中得到; 表皮生长因子来自(Waltham,MA); 所有其他试剂均从西格玛获得。 建立后,在添加10%热灭活胎牛血清(RIO)的RPMI1640中培养。 当观察到大量肿瘤细胞生长时,进行初始细胞传代。 随后每1~2周传代一次,贴壁培养在胰蛋白酶化后的亚汇合处传代。 如果在初始培养中注意到基质细胞生长,则使用胰蛋白酶获得纯肿瘤细胞群。 培养物在37°C的加湿培养箱中,在5%C02和95%空气的条件中培养。 从ATCC(Rockville,MD)获得HCC细胞系Hep3b和SK-Hep-1,以及肝母细胞瘤细胞系HepG2作为对照。
2.细胞系生长特性
通过将0.5~3×LO5活细胞接种到25cm2的烧瓶中,每天计数14天或更多天来确定群体生长时间。 培养物在计数前每3或4天和24小时换液一次。 用0.4%台盼蓝染色的染料排除法测定细胞活力方法并用血细胞计数仪计数活细胞。
为了对细胞系进行形态学研究,每天对生长在75cm2培养瓶上的细胞进行相差显微镜观察。 在Flaskette室载玻片(NUNC,Naperville,IL)上培养的细胞,用PBS洗涤,4%多聚甲醛和0.1M碳酸钙钠固定30min,苏木精和伊红染色。 以0.1kg/ml终浓度处理45 min后,用标准风干法从指数生长培养物中制备染色体玻片。 用快速G-显带法染色,并从SO中期扩散评估模式染色体数。 支原体污染用直接琼脂分离和微生物联合公司(Bethesda,MD)的Hoechst染色法检测。 所有品系都进行了细菌污染测试。 用Authentikit系统(康宁、东沃波尔、马萨诸塞州)对细胞匀浆进行淀粉凝胶电泳检测:乳酸脱氢酶、葡萄糖-6-磷酸脱氢酶、嘌呤核苷磷酸化酶和苹果酸脱氢酶。
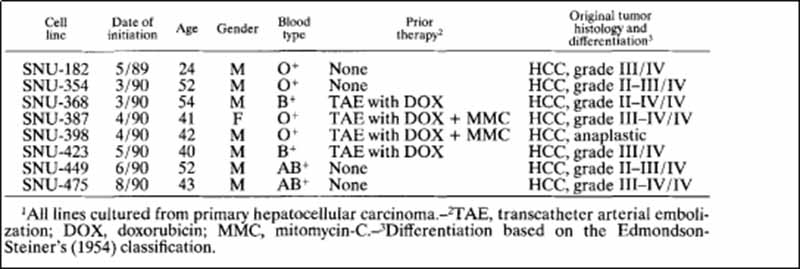
表I-肝癌细胞系的来源

3.甲胎蛋白(AFP)与乙型肝炎病毒测定
由放射免疫法测定细胞裂解液和培养上清中AFP和HBsAg蛋白水平。 将细胞(1×LO6)接种到2个75cm2的烧瓶中,半汇合时洗涤3次。 两天后,一个烧瓶中的细胞胰蛋白酶化后计算,然后丢弃。 从另一个烧瓶中收集细胞,洗涤3次,再次悬浮在1%非ID-P-40和100 p,m苯基甲基磺酰氟(约5~10 ng蛋白质/ml)中,在冰上超声两次15秒,在-70℃下保存直到检测。 从同一烧瓶中收集上清液,澄清,并冷冻保存,直到化验。 AFP用单克隆试剂盒(Dainabot,Tokyo,Japan)测定,HBSAG用另一个单克隆试剂盒(Abbott,North Chicago,IL)测定。
4. DNA和RNA提取
通过硫氰酸胍匀浆,然后在氯化铯垫上超速离心,从洗涤的细胞颗粒中获得总RNA和DNA。 随后,通过蛋白酶-K酶切和苯酚总管萃取法制备总基因组DNA(Sambrook et al.1989)。
5. 杂交探针
为了进行DNA图谱分析,使用3种多态性DNA探针,即2号染色体上的PYNH24(ATCC)、12号染色体上的CHDTC-15和20号染色体上的CHDTC-114来检测可变数量的串联重复序列(VNTRs)。 检测HBX和PreS/S转录本的HBV DNA是从韩国HBV感染者中分离的ADR亚型。 以pBR322的BamHI位点克隆2个拷贝的HBV DNA,从pHBV315二聚体质粒制备完整的X基因。 用pHBV315的nCOI/Alui片段作为X的探针,将pHBV315的一个部分消化的Hincii片段克隆到pUC19的Hincii位点。 用BSTXI/PSTI消化529bp的HBV DNA片段克隆到pUC19中,进行PRES/S探针。 用探针PAM6(ADW亚型,ATCC)检测病毒DNA整合和HBV基因表达。 如所述,IGF-I1探针的TaqI/Clai片段从pyrm-114载体中分离。 P-肌动蛋白序列编码的cDNA克隆(来自J.Battey,NCI,Bethesda,MD)用于比较RNA载量。 用随机引物DNA标记试剂盒(Boehringer Mannheim,Indianapolis,In)用[W~P]~CTP(3000ci/mmol)标记探针。
6.Southern杂交技术在HBVDNA图谱及鉴定中的应用
用70个单位的HINFF限制性内切酶消化10微克DNA样品,用0.7%琼脂糖凝胶电泳分离,转移到Hybond-N+尼龙膜(Amersham,Arlington Heights,IL)。 在6×SSC,0.1%SDS,5×Denhardt溶液中,在沙门氏菌DNA存在下,于65℃预杂交膜。 与高度多态性探针PYNH24、CHDTC-15和CHDTC-114进行杂交(Honma et al.1991)。 杂交后,在室温下2×SSC/O.L%SDS中洗涤两次20 min,在60℃下1×SSC/0.1%SDS中洗涤两次10 min。 杂交后的膜在-70℃下暴露于柯达XARJ胶片(伊士曼柯达,罗切斯特,纽约州)1-3天。 在另一个实验中,用HAEIII限制性内切酶消化DNA,并如上所述与PYNH24杂交。 为鉴定HBV DNA整合,每个DNA样品10 pg用10单位EcoRI或Hindiii分别经电泳分离,转移到尼龙膜上。 以C-~-~P标记的3.2kb全长HBV DNA克隆(PAM6)为探针。 杂交和放射自显影按上述方法进行。
7.HBC、IGF-II及肝相关基因的表达 动脉血气测量
小每株细胞的总RNA(20 pg)在1%琼脂糖GE1/6%甲醛上电泳,在10×SSC中浸泡两次20分钟,转移到Hybond-N+尼龙膜(Amersham)上。 用比活性为3×LO8cpm/ml的随机引物标记的探针(HBV、HBX、PRES/S和IGF-11)在42℃下杂交16小时,然后在室温和42℃下用2×SSC/O.1%SDS洗涤。 放射自显影是在-70℃下进行的。 为了确定AFP、白蛋白和转铁蛋白(TF)基因的THC表达,用ABI 381A DNA合成器(Application Biosystems,Forster City,CA)合成AFP(Morigana et al.1983)、白蛋白(Lawn et al.1981)和TF(Yang el al.1984)特异地合成寡核苷酸序列,用Bio-Spin 6柱(Bio-Rad,Richmond,CA)纯化,用T4多核苷酸激酶(Gibco/BRL)磷酸化[Y-32P]DATP标记S端。 杂交和放射自显影按上述方法进行。
研究结论
1.细胞系特征
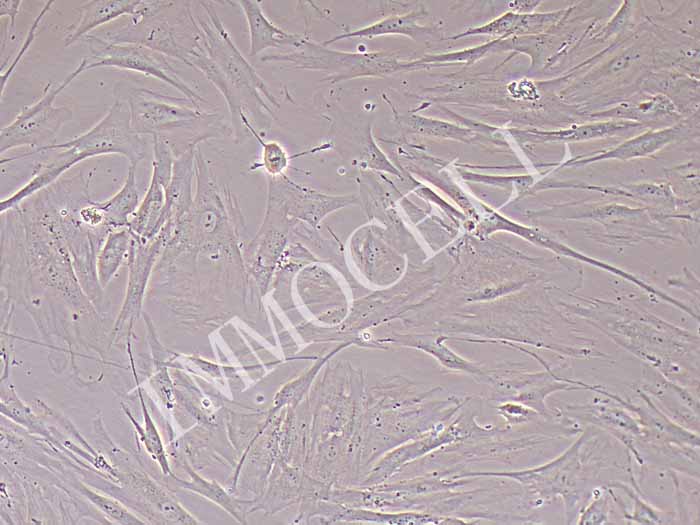
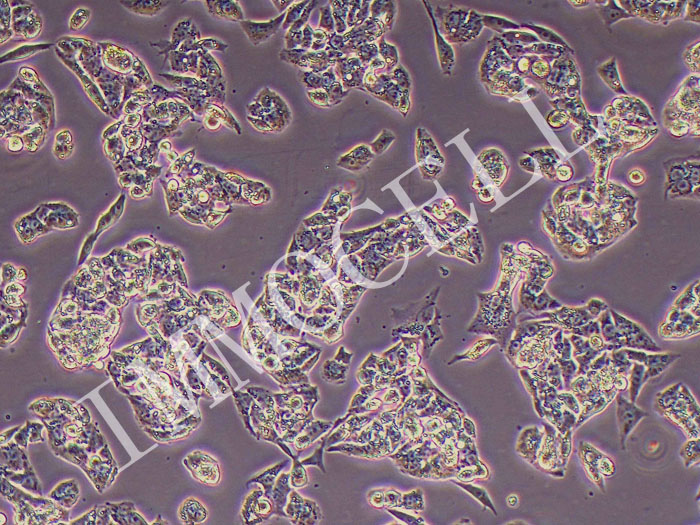
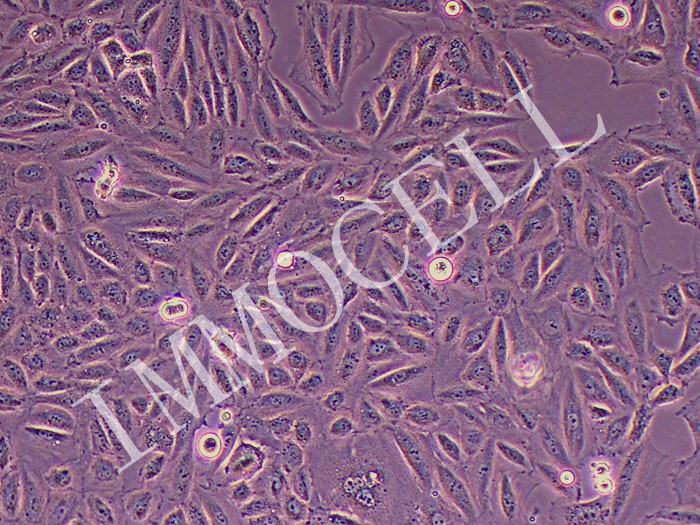
在AR5培养基中建立了8株肝癌细胞系,均来源于韩国人的原发肿瘤。4例患者曾接受过碘油加阿霉素单独或阿霉素与丝裂霉素-C联合应用的经导管动脉栓塞(TAE)治疗(表一)。 群体倍增时间为34~72小时,细胞活力为74~99%。 所有品系都表达了4种酶的人类形式,所有品系都不受细菌或支原体的污染。 形态学研究为了进行形态学分析,研究人员根据WHO标准和其他分类系统对原始肿瘤的大体和组织学特征进行分类。 原发肿瘤多为单发结节(SNU182、SNU-354、SNU-368和SNU-387)、单发结节伴结节周围扩展(SNU-398、SNU-423和SNU-449)或块状生长型(SNU-475)。 组织学上,原发肿瘤包括以致密小梁型为主(SNU-387,SNU-449和SNU-475)(图L),小梁型(SNU-354,SNU-398和SNU-423)(图),或以小梁和小腺泡型为主(SNU-182和SNU-368)。 多数肿瘤分化较差,但单个细胞形态与正常肝细胞相似,符合图1型肝硬化组。 SNU-398和SNU-423的原发肿瘤均为多形细胞型。 SNU-398由小型间变性细胞组成和多核肿瘤巨细胞的SNU-423。 这2个肿瘤的形态如图2所示。 在几种细胞系(SNU-368、SNU-398和SNU-423)的原发肿瘤中,细胞浆内透明球较常见。 培养中,除SNU-398外,其余细胞均为贴壁细胞。 SNU-398系来源于多形性Ⅳ级癌,生长为漂浮细胞和贴壁细胞。 肿瘤细胞多呈多角形,胞质丰富,细胞核大、圆、泡状,有多个核仁。 部分细胞系(SNU-398、SNU-423和SNU-475)为多核肿瘤细胞。 一些细胞维持胞浆内透明球(SNU-368、SNU-398和SNU-423)的产生,如原始肿瘤(图2)所示。 SNU-387细胞株在原发肿瘤和细胞株中均表现出明显的核卷积。 三个细胞系(SNU-387、SNU-449和SNU-475)来源于原始肿瘤,表现出主要的致密生长模式,生长为弥散扩散的单层细胞。 其余细胞系(SNU-182、SNU-354、SNU-368、SNU-398和SNU-423)均来源于原发肿瘤小梁排列。 这些细胞系呈扩散聚集型生长。 原始肿瘤和培养肿瘤的形态学特征的比较总结在表III中。
表3-肝癌细胞系的WTRO和体内特性
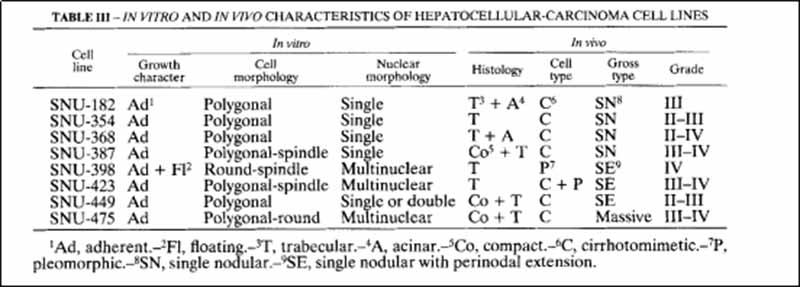
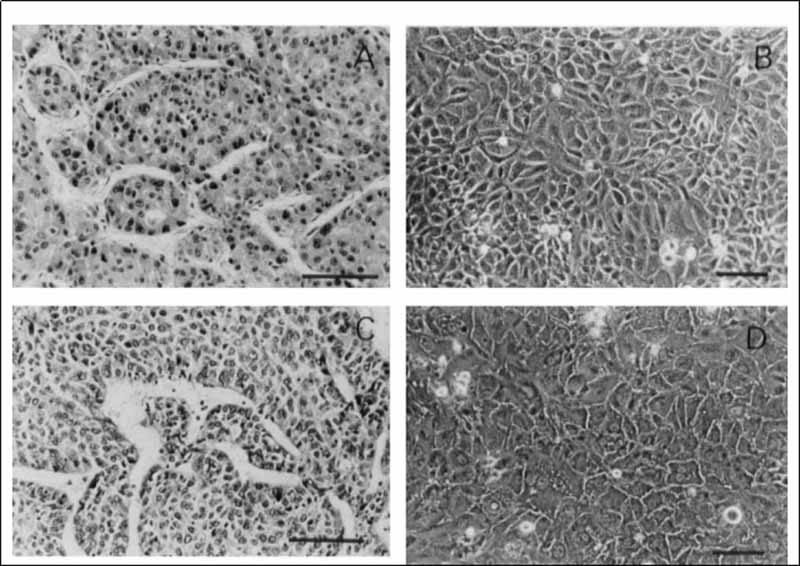
图1-拟肝硬化型肝细胞癌的形态学。 (A)SNU-368原发肿瘤表现为小梁和腺泡组织学(H+E染色)。 (b)SNU-368相差显微镜显示均匀多边形贴壁细胞。 (c)SNU-475原发肿瘤呈致密小梁组织学(H+E染色)。 (d)培养的SNU-475细胞由可变大小的多边形细胞组成。 刻度尺50um。
图2-多形型肝细胞癌的形态学。 (A)SNU-398原发肿瘤由间变性小细胞组成(H+E染色)。 (B)培养的SNU-398细胞由混合的黏附细胞和漂浮细胞组成。 (c)SNU-423原发肿瘤为小梁型多核巨细胞(H+E染色)。 (D)培养的SNU-423细胞可见多核多角形细胞和小梭形细胞。 刻度杆,50um。
2.AFP和HBsAg
在培养的细胞裂解液和上清液中,AFP和HBsAg蛋白水平均低于可检测水平。
3.细胞遗传学研究
细胞遗传学研究表明,所有的细胞系都是非整倍体,模式染色体数目从57到85不等(表2)。
3.DNA Profies与HBVDNA整合
应用限制性内切酶HINFL和多态性DNA探针PYNH24、CHDTC-15和CHDTC114对8株SNU HCC细胞株进行了DNA图谱分析,结果表明8株SNU HCC细胞株是不同的细胞株(图3)。 与已存在的3种HCC细胞株SK-Hep-1、Hep3b和HepG2相比,它们也显示出不同的DNA图谱。 CHDTC-114的等位基因带数大于14条(1.9~5.1kb),CHDTC-15的等位基因带数大于19条(4.6~23.1kb)。 用限制性内切酶HAEII和多态性DNA探针PYNH24对8株SNU HCC细胞株进行DNA图谱分析,结果显示8株SNU HCC细胞株有10条以上的等位基因带,大小为1.1~2.7kb。 这些结果可以排除细胞系之间交叉污染的任何可能性。 用Southern印迹杂交法(图4)在Ecori和Hindiii消化的细胞DNA中均检测到2 3KB2 OKB乙型肝炎病毒DNA。 相对较高分子量的酶切带提示HBV DNA的整合形式。 每个细胞系显示不同的HBV整合模式。
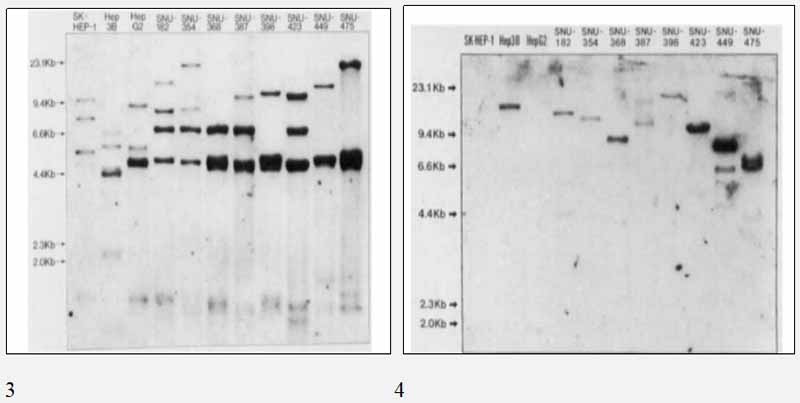
图3--HINFL Southern杂交HCC细胞株的DNA图谱,与CHDTC-15和CHDTC-114杂交。 这8株SNU
HCC细胞系是独一无二的,且无亲缘关系。图4-Hindiii消化的HCC细胞株DNA中RGURE 4整合的HBV DNA序列。
4.RNA表达
Hep3b(3.2kb)和Snu-368(3.2kb)检测HBV基因组RNA。 Snu-354也显示HBV基因组RNA弱表达,但转录本的大小较小,只有2.3kb。 HBx转录本在Hep3b,Snu-354(2.3kb)和Snu-368(3.2kb)(图5)中表达。 PreS/S RNA在所有细胞系中均未表达。 IGF-I1 RNA在Hep 3b、Hep G2和Snu-368(图5)中均有表达。无一例细胞在RNA水平上产生AFP,证实了放射免疫分析的结果。 白蛋白RNA仅在SNU-354中检测到,TF RNA仅在SNU-368(图6)中检测到。 SNU-449中白蛋白的表达及SNU-449和SNU-475中TF的表达均在检测范围内。 在Hep 3b和Hep G2细胞系中检测到AFP、白蛋白和TF的RNA,这与以前的结果一致(Miyazaki and Narnba,1994)。
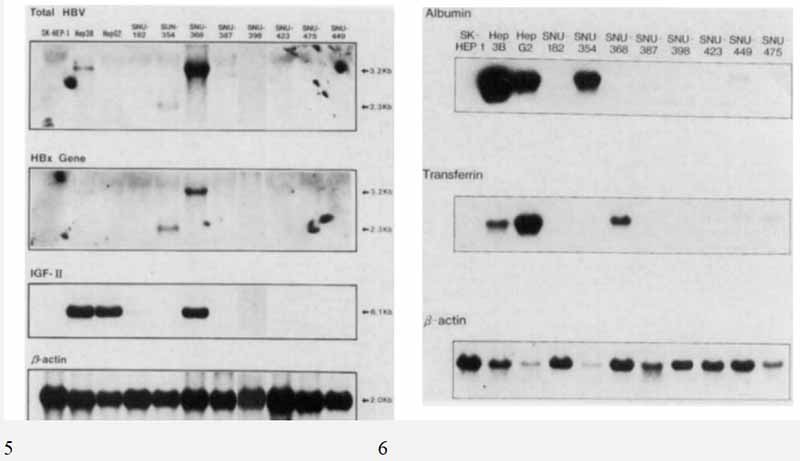
图5-SNU肝癌细胞系HBV转录本和IGF-I1的RNA表达模式。
图6-使用32P标记的白蛋白和转铁蛋白特异性合成寡核苷酸探针对肝癌细胞株进行Northern-blot分析。
讨论
HBV基因整合在慢性感染和肝癌中的发现导致了基于HBV整合在肝癌发展中的研究。 HBV基因整合的HCCs永久细胞系应为阐明HBV相关的人肝癌发生机制提供良好的基础,因为纯细胞培养可用于各种无法在组织标本上进行的研究。 然而,自1985年以来,关于建立肝癌细胞系的报道明显减少,最近将肝癌细胞培养为永久系的尝试有些令人失望。 据研究人员所知,目前大约有40种人肝细胞肿瘤细胞系,包括文献中提到的HCCS和肝母细胞瘤。 此外,在宿主基因组中整合HBV基因的HCC细胞株数量有限。 新建立的HBV基因整合的HCC细胞系有望拓宽HBV相关HCCS的研究范围。本文报道了8株新建立的HBV基因整合的肝癌细胞株。 结果表明,AR5培养基在人肝细胞选择性生长中的成功率为29%(28个试验中有8个),反映了AR5培养基在人肝细胞选择性生长中的相对效率诺玛。 8株肝癌细胞的群体倍增时间为34~72h,细胞活力为74~99%。 所有品系均为非整倍体,模式染色体数目在57~85之间。 用多态性DNA探针PYNH24、CHDTC-15和CHDTC114进行DNA指纹图谱分析,发现这8株HCC细胞株与SK-Hep-1、Hep3b和HepG2细胞株是唯一的、无亲缘关系的。 从肝癌建立的细胞系的形态学特征尚未得到充分详细的讨论。 在研究人员的细胞系中,研究人员观察到两种类型的生长特征,包括扩散生长和扩散聚集生长模式。 这些细胞系的生长模式似乎与原发肿瘤的生长模式有关。 表现为弥散生长的细胞系来源于以致密生长为主的肿瘤,而表现为扩散和聚集生长的细胞系来源于小梁和/或假腺体生长的肿瘤。 此外,大多数培养的细胞保持了原肿瘤的形态特征,包括胞浆内透明球、染色质模式和核形状。 研究人员认为,尽管细胞系在培养过程中可能发生了形态和功能上的改变,但由于其环境适应,它们仍然保持了它们所衍生的原始肿瘤的大部分形态特征。 已知HBV(HBX)的X基因在肝癌发展中起着重要作用,因为它具有跨激活基因表达的能力。最近关于PreS/S序列截断形式的数据显示,在许多不同的启动子上有转录的跨激活子功能,提示HBV存在一个额外的病毒跨激活子在肝癌形成过程中发挥作用。 为了了解整合的HBV基因在研究人员的细胞系中是否有转录活性,研究人员检测了HBV病毒的表达模式转录本,使用总HBV、HBX和PRES/S基因的cDNA探针。 HBV基因组RNA在SNU-368和Hep3b细胞系中表达。 已知细胞系Hep3b有1至2个HBV DNA拷贝整合到宿主基因组中,并表达各种大小的HBV病毒转录物。 Snu-354也表达HBV基因组RNA,但表达量小于Snu-368和Hep3b。 这可能反映了HBV基因的一种截断形式。 HBX基因转录本仅在Snu-354和Snu-368中表达。 在自然感染的肝细胞中,主要的病毒RNA转录本大小分别为2.3kb和3.5kb,分别来自S启动子和C启动子这两个启动子产生X蛋白。 在SNU-354和SNU-368中的发现与这些值非常接近,尽管还没有对整合的HBV基因进行准确的分析。 PreS/S基因转录本在所有细胞系中均未表达。 对原发性人HCCs的研究表明,在大多数病例中,IGF-I1 RNA表达的胎肝模式。 本研究在Hep 3b、Hep G2和SNU-368中表达了一个5.6kb的IGF-I1转录本。 研究人员在此描述了8个新建立的HCC细胞系的特征,所有细胞系的基因组中都整合了HBV DNA,但只有2个细胞系表达HBV和HBX转录本,而没有一个细胞系表达PreS/S基因转录本。 为了解释这些发现与肝癌病因的关系,研究人员目前正在研究p53基因突变与整合HBV DNA转录活性之间的关系。 新特征的HCC细胞株应为研究人肝细胞癌提供良好的体外模型。
大家都在看
-
THP-1细胞培养指南及常见问题:THP-1细胞培养基:90% 1640+10% FBS+PS+ 0.05 mM 2-巯基乙醇(2-mercaptoethanol),如果THP-1细胞密度达80%-90%,即可进行传代培养,传代比例:1:2至1:3,THP-1细胞有密度依赖性,低密度时细胞···...
阅读详情 -
vero细胞培养条件及方法:vero细胞培养基MEM+10%FBS+1%PS,如果vero细胞密度达80%-90%,即可进行传代培养,传代比例:1:2至1:3,每周 2-3次,vero细胞生长条件:气相:95%空气+5%二氧化碳;温度:37℃...
阅读详情 -
MCF-7细胞培养条件及注意事项:MCF-7细胞培养基89%DMEM+10%FBS+1%PS+0.01mg/ml insulin,培养条件气相:95%空气+5%二氧化碳;温度:37℃,培养箱湿度70%-80%,MCF-7细胞贴壁较慢,处理后最好48h后再观察,MCF-7细胞培养需要加···...
阅读详情 -
RAW 264.7细胞培养传代及冻存处理:需要准备培养基:DMEM+10%FBS+PS、培养皿、无血清冻存液,RAW 264.7细胞传代步骤如下,a、将含有1mLRAW 264.7细胞悬液的冻存管在 37℃水浴中迅速摇晃解冻,加4 mL培养基混合均匀;b、在1···...
阅读详情 -
MDCK细胞培养方法及应用:MDCK细胞培养基:MEM(ATCC改良)+10%FBS+PS,生长条件;气相:95%空气+5%二氧化碳;温度:37℃,MDCK细胞被广泛用作远曲小管或集合管的模型,还可用于代谢研究和Pg级药物与药物相互作用研究以及观察流···...
阅读详情 -
乳腺癌研究常用细胞系及其优化实验方案:绝大多数乳腺癌都是起始于乳腺导管细胞,只有10%的乳腺癌起始于乳腺小叶细胞,另有一些罕见起源的乳腺癌种类,由于乳腺附近存在淋巴结和淋巴腺,这也是乳腺癌易于扩散转移的原因之···...
阅读详情
相关问答
-
细胞名称:A7r5细胞系(A7R5大鼠胸大动脉平滑肌细胞)客户问题:细胞中黑色的是什么?原因分析:1.棉球纤维、凋亡细胞片、血清蛋白,或一些无血清培养基添加因子后的因子析出物,属于正常现象;2.如果是传代后细胞堆···...
阅读详情 -
细胞增殖速度怎么变得这么慢了?细胞发生病变,出现细胞变圆、从培养瓶壁脱落又是什么情况?要疯了,培养细胞怎么就这么难呢~实验过程中存在的“幽灵”,即使是经验丰富的老研究员也不得不面对,没错,它就是支原体感···...
阅读详情 -
胎牛血清和小牛血清的差别在哪里? 胎牛血清和小牛血清的差别在哪里? 胎牛血清(FBS) :从八月龄胎牛心脏穿刺取血。适用于专业的研究和试验,包括干细胞研究、免疫分析和抗体生产。 新生牛血青/小牛血清(NBCS) :从自出···...
阅读详情 -
适合细胞长期保存的温度是多少? 适合细胞长期保存的温度是多少? 细胞长期保存温度是-130°C或更低。液氮罐中气态层温度在-140°C至-180°C之间细胞可保存在气态层或浸入液氮中,如果可以最好保存在气态层,因为这样···...
阅读详情 -
如何在细胞铺板时避免“边缘效应”? 如何在细胞铺板时避免“边缘效应”? 以下这三点一定要注意!细胞实验铺板时,为避免“边缘效应”,以应用96孔板的中间60孔为最佳,一般四周的一圈边缘孔不养细胞,只做空白或阴性···...
阅读详情 -
如何收获需要冻存的细胞?最佳是什么时候?如何收获需要冻存的细胞?最佳是什么时候?用来冻存的细胞一般选择在细胞约铺满90%的时候,这时细胞生长状态好,细胞数量也多并且在收获细胞前24小时换一次培养液。收获用来冻···...
阅读详情