体外培养细胞的生长增殖能力的判定,不仅代表了细胞的基本属性,也是进行药物检测、转化检测、培养基筛选等许多方面的重要监测指标。判定细胞增殖能力的指标主要是生长曲线、分裂指数、克隆形成率及细胞活力等测定。
细胞生长状况有关指标的检测方法
一、细胞计数
这是细胞培养中常用的基本技术之一。所用材料为血球计数板,巴氏吸管和显微镜。
细胞计数的基本步骤
(1)取清洁计数板和专用盖玻片,用丝绸布轻轻拭干。
(2)取细胞悬液0.3mL,加入0.9mL结晶紫(或台盼至)染液,混匀后滴半滴于血球计数板内,以充满不外溢为宜。也可直接将细胞悬液在一侧滴加到盖玻片中,不要溢出,也不要过少或出现气泡.
(3)在显微镜下用10×物镜观察计数四角大分格中的细胞数。代入下式得出细胞密度。细胞数/ml=(4大格细胞数之和/4)×104×稀释倍数台盼蓝染色法可计算出活细胞数和死细胞数以测定细胞存活百分率。一般0.5%~1%的台盼蓝染液可使死细胞染成蓝色,活细胞不着色。此外还可用0.02%的藻红B染液将死细胞或受损细胞染成红色,或用0.05%的苯胺黑染液将死细胞染成黑色。细胞存活百分率=(4大格活细胞数/4大格活细胞+死细胞数)×100%细胞计数除用上述方法外,目前还有新型的自动计数仪,可供大规模细胞计数工作使用。各种型号的计数操作不尽相同,可根据使用说明进行操作。在进行细胞计数操作时,必须把细胞悬液准备好,细胞应分散良好,并充分混匀,若出现较多细胞团或细胞数少于200个/10mm2或多于500个/10mm2时,需重制细胞悬液,重新计数。
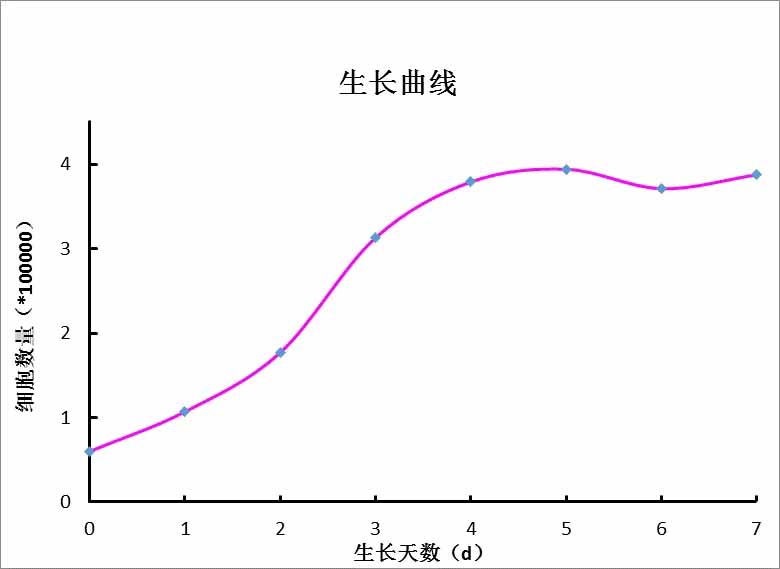
二、细胞生长曲线和生长倍数
生长曲线是培养细胞生物学特性的基本参数之一,是测定细胞绝对生长数的常用方法,也是判定细胞活力的重要指标。
常用于测定药物等外来因素对细胞生长的影响!
细胞生长曲线是细胞培养实验中最基本的指标,是测定细胞绝对增长数值和生长繁殖基本规律常用的简便方法。
常用的方法为
在同一规格的培养瓶中,接种同等量的同一代细胞,经培养后每隔24小时取出几瓶细胞进行计数,以培养时间为横座标,不同时刻的细胞数的对数为底座标,标出各点并连成线,即为该细胞的生长曲线,可反应出细胞生长的动态。测定生长曲线的另一种方法是用96孔/24孔细胞培养板,分7组,每组3孔,培养一周(7天),期间逐日检测一组,计数,最后把7天中的细胞数值绘成图,即为细胞生长曲线。也可采用MTT法来进行生长曲线测定,较上述方法简便。标准的细胞生长曲线近似“S”形,一般在传代后第一天细胞数有所减少,经过一段时间的潜伏期,再进入对数生长期,达到平台期和生长稳定,最后衰老。细胞生长倍数是指测定接种时活细胞的浓度,经一个生长周期达到最大活细胞浓度的比率。生长倍数=培养后最大活细胞浓度/接种时的活细胞浓度。
三、细胞分裂指数细胞分裂指数
细胞分裂指数细胞分裂指数是表示细胞增殖旺盛程度的指标。它以被测1000个细胞中的分裂细胞数来计算。其方法为:用秋水仙素将细胞处理1~2小时后,按染色体制片法制片并染色,计算1000个细胞中分裂相的数目,重复4次取平均值,用百分比表示。
基本步骤
(1)细胞准备用盖片(支持物)培养法。
(2)每24小时取出一个小玻片,按常规方法进行固定,吉姆萨或HE染色,封片,制成永久标本。
(3)显微镜下选择细胞密度适中的区域观察分裂细胞并计数。逐个视野进行,对每一时间组的玻片各取细胞多、中、少3个区域各一区,共数1000个细胞,计算出平均分裂相值所占百分比。观察时要掌握好分裂相标准,主要是确定好划分间期和前期,末期和间期等的界限,以减少误差。
细胞分裂指数=细胞分裂相数/细胞总数(1000)×1000
四、细胞接种存活率
细胞接种存活率又称细胞贴壁率。它是细胞被制成分散的悬液后,以低密度(2~5个细胞/cm2)被接种到底物上,贴壁并能存活生长形成细胞小群(克隆)的细胞百分数值,用以表示细胞的生存能力和细胞群的活力。
基本步骤
(1)取对生长期细胞,用消化法制成细胞悬液,计数后按检测细胞生长曲线的接种细胞的原则,将细胞接种于培养瓶(浓度相对高些)。接种12~15瓶。
(2)每2小时取出一瓶细胞,倒掉培养液,然后加入胰酶消化已贴壁细胞,计数已贴壁细胞,用下面公式逐个计算每个时间上的贴壁率。每2小时一次,共观察24小时即12。
接种存活率%(贴壁率)=(贴壁存活细胞数/接种细胞数)×100%
五、克隆形成率
细胞接种存活率只表示接种细胞后贴壁的细胞数,但贴壁后的细胞不一定每个都能增殖和形成克隆。而形成克隆的细胞必为贴壁和有增殖活力的细胞。克隆形成率反映细胞群体依赖性和增殖能力两个重要性状。由于细胞生物学性状不同,细胞克隆形成率差别也很大,一般初代培养细胞克隆形成率弱,传代细胞系强;二倍体细胞克隆形成率弱,转化细胞系强;正常细胞克隆形成率弱,肿瘤细胞强。并且克隆形成率与接种密度有一定关系,做克隆形成率测定时,接种细胞一定要分散成单细胞悬液,直接接种在碟皿中,持续一周,随时检查,到细胞形成克隆时终止培养。
1.平板克隆形成试验基本步骤
(1)取对数生长期的单层培养细胞,用0.25%胰蛋白酶消化并吹打成单个细胞,把细胞悬浮在10%胎牛血清的RPMI1640培养液中备用。
(2)将细胞悬液作梯度倍数稀释,以适当的细胞密度(根据增殖能力)接种于培养皿中。一般分每皿50、100、200个细胞的梯度密度分别接种含10mL 37℃预温培养液的皿中,并轻轻转动,使细胞分散均匀。置37℃ 5% CO2及饱和湿度的环境下,静置培养2~3周。
(3)经常观察,当培养皿中出现肉眼可见的克隆时,终止培养。弃去上清液,用PBS小心浸洗2次。加纯甲醇或1:3醋酸/甲醇5mL,固定15分钟。然后去固定液,加适量Giemsa应用染色液染10~30分钟,然后用流水缓慢洗去染色液,空气干燥。
(4)将平皿倒置并叠加一张带网格的透明胶片,用肉眼直接计数克隆,或在显微镜(低倍镜)计数大于10个细胞的克隆数。最后计算克隆形成率。
克隆形成率= 克隆数/接种细胞数×100%
接种细胞数平板克隆形成试验方法简单,适用于贴壁生长的细胞。适宜底物为玻璃的、塑料瓶皿。试验成功的关键是细胞悬液的制备和接种密度。细胞一定要分散得好,不能有细胞团,接种密度不能过大。
2.软琼脂培养克隆形成试验基本步骤
(1)取对数生长期细胞,用0.25%胰蛋白酶消化并轻轻吹打,使之成为单细胞,作活细胞计数,用含20%胎牛血清的DMEM培养液调整细胞密度至1×106细胞/L。然后根据实验要求作梯度倍数稀释。
(2)用蒸馏水分别制备出1.2%和0.7%两个浓度的低溶点琼脂糖液,高压灭菌后,维持在40℃中不会凝固。
(3)按1:1比例使1.2%的琼脂糖和2×DMEM培养基(含有2×抗生素和20%的小牛血清)混合后,取3mL混合液注入直径6cm平皿中(10cm平皿加7~10mL),冷却凝固,可作底层琼脂置CO2温箱中备用。
(4)按1:1比例让0.7%的琼脂糖和2×DMEM培养基在无菌试管中相混以后,再向管中加入0.2mL的细胞悬液,充分混匀,注入铺有1.2%琼脂糖底层平皿中,逐形成双琼脂层。待上层琼脂凝固后,置入37℃ 5%CO2温箱中培养10~14天。
(5)把平皿放置在倒置显微镜下,观察细胞克隆数。计算形成率。软琼脂培养法常用检测肿瘤细胞和转化细胞系。试验中琼脂与细胞相混时,琼脂温度不宜超过40℃。接种细胞的密度每平方厘米不超过35个,一般6cm的平皿接种1000个细胞。正常细胞在悬浮状态下不能增殖,不适用于软琼脂克隆形成试验。
六、细胞周期
标记有丝分裂百分率法(percentage labeledmitoses,PLM)
对测定细胞进行脉冲标记、定时取材、利用放射自显影技术显示标记细胞,通过统计标记有丝分裂细胞百分数的办法来测定细胞周期。放射标记物为3H或者14C标记的TdR。
七、MTT法测定细胞活力
四唑盐(MTT)商品名为噻唑蓝,四唑盐比色法的原理:活细胞线粒体中琥珀酸脱氢酶能将四唑盐还原成不溶干水的蓝紫色产物甲躜(formazan),并沉淀在细胞中,而死细胞没有这种功能。二甲亚砜(DMSO)能溶解沉积在细胞中蓝紫色结晶物,溶液颜色深浅与所含的formazan量成正比。再用酶标仪测定OD值。
MTT法简单快速、准确,广泛应用于新药筛选、细胞毒性试验、肿瘤放射敏感性实验等。
操作步骤
(1) 细胞悬液接种于96孔培养板; 103-104细胞/孔,每孔培养基总量200微升(96孔培养板每孔容积370微升),37°C、5%CO2培
养箱中培养一段时间(根据实验目的决定培养时间)。
(2)加入2毫克/毫升的MTT液(50微升/孔);继续培养3小时。
(3)吸出孔内培养液后,加入DMSO液(150微升/孔),将培养板置于微孔板扳荡器上振荡10分钟,使结晶物溶解。
(4)酶标仪检测各孔OD值(检测波长570纳米)。记录结果,绘制细胞生长曲线。
每隔24小时测量一个点,3个平行样品!
大家都在看
-
THP-1细胞培养指南及常见问题:THP-1细胞培养基:90% 1640+10% FBS+PS+ 0.05 mM 2-巯基乙醇(2-mercaptoethanol),如果THP-1细胞密度达80%-90%,即可进行传代培养,传代比例:1:2至1:3,THP-1细胞有密度依赖性,低密度时细胞···...
阅读详情 -
vero细胞培养条件及方法:vero细胞培养基MEM+10%FBS+1%PS,如果vero细胞密度达80%-90%,即可进行传代培养,传代比例:1:2至1:3,每周 2-3次,vero细胞生长条件:气相:95%空气+5%二氧化碳;温度:37℃...
阅读详情 -
RAW 264.7细胞培养传代及冻存处理:需要准备培养基:DMEM+10%FBS+PS、培养皿、无血清冻存液,RAW 264.7细胞传代步骤如下,a、将含有1mLRAW 264.7细胞悬液的冻存管在 37℃水浴中迅速摇晃解冻,加4 mL培养基混合均匀;b、在1···...
阅读详情 -
MCF-7细胞培养条件及注意事项:MCF-7细胞培养基89%DMEM+10%FBS+1%PS+0.01mg/ml insulin,培养条件气相:95%空气+5%二氧化碳;温度:37℃,培养箱湿度70%-80%,MCF-7细胞贴壁较慢,处理后最好48h后再观察,MCF-7细胞培养需要加···...
阅读详情 -
MDCK细胞培养方法及应用:MDCK细胞培养基:MEM(ATCC改良)+10%FBS+PS,生长条件;气相:95%空气+5%二氧化碳;温度:37℃,MDCK细胞被广泛用作远曲小管或集合管的模型,还可用于代谢研究和Pg级药物与药物相互作用研究以及观察流···...
阅读详情 -
常用人肝癌细胞系有哪些及如何选择:目前较为常用的几株人肝癌细胞系SMMC-7721、Bel-7402、MHCC97、HepG2、Hep3B、Huh-7 and PLC/PRF/5,那么人肝癌细胞株如何选择呢?一方面你可以查找相关的文献,另一方面可以考虑选择···...
阅读详情
相关问答
-
细胞名称:A7r5细胞系(A7R5大鼠胸大动脉平滑肌细胞)客户问题:细胞中黑色的是什么?原因分析:1.棉球纤维、凋亡细胞片、血清蛋白,或一些无血清培养基添加因子后的因子析出物,属于正常现象;2.如果是传代后细胞堆···...
阅读详情 -
细胞增殖速度怎么变得这么慢了?细胞发生病变,出现细胞变圆、从培养瓶壁脱落又是什么情况?要疯了,培养细胞怎么就这么难呢~实验过程中存在的“幽灵”,即使是经验丰富的老研究员也不得不面对,没错,它就是支原体感···...
阅读详情 -
胎牛血清和小牛血清的差别在哪里? 胎牛血清和小牛血清的差别在哪里? 胎牛血清(FBS) :从八月龄胎牛心脏穿刺取血。适用于专业的研究和试验,包括干细胞研究、免疫分析和抗体生产。 新生牛血青/小牛血清(NBCS) :从自出···...
阅读详情 -
适合细胞长期保存的温度是多少? 适合细胞长期保存的温度是多少? 细胞长期保存温度是-130°C或更低。液氮罐中气态层温度在-140°C至-180°C之间细胞可保存在气态层或浸入液氮中,如果可以最好保存在气态层,因为这样···...
阅读详情 -
如何在细胞铺板时避免“边缘效应”? 如何在细胞铺板时避免“边缘效应”? 以下这三点一定要注意!细胞实验铺板时,为避免“边缘效应”,以应用96孔板的中间60孔为最佳,一般四周的一圈边缘孔不养细胞,只做空白或阴性···...
阅读详情 -
如何收获需要冻存的细胞?最佳是什么时候?如何收获需要冻存的细胞?最佳是什么时候?用来冻存的细胞一般选择在细胞约铺满90%的时候,这时细胞生长状态好,细胞数量也多并且在收获细胞前24小时换一次培养液。收获用来冻···...
阅读详情