简介
小胶质细胞是一种神经胶质细胞(神经胶质细胞),遍布大脑和脊髓。小胶质细胞约占脑内细胞的 10-15%。作为驻留巨噬细胞,它们充当中枢神经系统(CNS)中第一种也是主要的主动免疫防御形式。小胶质细胞起源于卵黄囊,受到严格调控的分子过程。这些细胞(以及包括星形胶质细胞在内的其他神经胶质细胞)分布在整个 CNS 的大型不重叠区域。小胶质细胞是整个大脑维护的关键细胞——它们不断清除 CNS 中的斑块、受损或不必要的神经元和突触以及传染性病原体。由于这些过程必须有效以防止潜在的致命损伤,因此小胶质细胞对 CNS 中的哪怕是微小的病理变化也极为敏感。这种敏感性部分是通过独特的钾通道的存在实现的,这些钾通道对细胞外钾的哪怕是微小的变化都会作出反应。最近的证据表明,小胶质细胞也是健康条件下维持正常大脑功能的关键因素。小胶质细胞还通过直接的躯体接触不断监测神经元功能,并在需要时发挥神经保护作用。
由于存在一系列内皮细胞(称为血脑屏障,BBB),大脑和脊髓构成了中枢神经系统,身体循环中的致病因素通常不会直接进入大脑和脊髓。血脑屏障可防止大多数感染到达脆弱的神经组织。当传染性病原体直接进入大脑或穿过血脑屏障时,小胶质细胞必须迅速做出反应,以减少炎症并在传染性病原体损害敏感的神经组织之前将其消灭。由于缺乏来自身体其他部位的抗体(很少有抗体小到可以穿过血脑屏障),小胶质细胞必须能够识别异物、吞咽它们,并充当激活T 细胞的抗原呈递细胞。
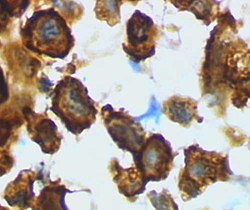
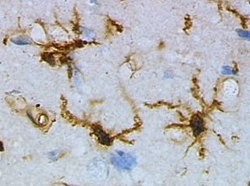
创伤性脑损伤前大鼠皮质中的静息状态小胶质细胞 小胶质细胞/巨噬细胞——创伤性脑损伤后大鼠皮质的活化形式
(用HRP进行凝集素染色) (用 HRP 进行凝集素染色)
发展历史
人们开始能够观察和表征不同的神经细胞(包括小胶质细胞)是在 1880 年,当时Franz Nissl开发了尼氏染色法。Franz Nissl 和 William Ford Robertson 在他们的组织学实验中首次描述了小胶质细胞。19 世纪 80 年代的细胞染色技术表明小胶质细胞与巨噬细胞有关。Victor Babeş在 1897年研究狂犬病病例时首次注意到小胶质细胞的激活和分支小胶质细胞簇的形成。Babeş注意到这些细胞存在于多种病毒性脑感染中,但不知道他所看到的小胶质细胞簇是什么。西班牙科学家Santiago Ramón y Cajal定义了除神经元和星形胶质细胞之外的“第三种元素”(细胞类型)。 圣地亚哥·拉蒙-卡哈尔的学生皮奥·德尔里奥·霍特加 (Pío del Río Hortega)于 1920 年左右首次将这些细胞称为“小胶质细胞”。他于 1927 年进一步描述了小胶质细胞对脑损伤的反应,并于 1932 年注意到胼胝体和其他围产期白质区域存在“小胶质细胞喷泉”。经过多年的研究,里奥·霍特加被公认为“小胶质细胞之父”。很长一段时间以来,我们对小胶质细胞的认识几乎没有任何进展。后来,在 1988 年,希基和木村发现血管周围小胶质细胞来自骨髓,并表达高水平的MHC II 类蛋白,用于抗原呈递。这证实了皮奥·德尔里奥-霍特加的假设,即小胶质细胞的功能类似于巨噬细胞,通过进行吞噬作用和抗原呈递。[需要引证]
表达
在组织培养中生长的大鼠小胶质细胞显示为绿色,神经纤维突起显示为红色。大鼠小脑分子层中的小胶质细胞呈红色,用 IBA1/AIF1 抗体染色。伯格曼胶质细胞突起呈绿色,DNA 呈蓝色。小胶质细胞具有极强的可塑性,会根据位置和系统需求发生各种结构变化。这种可塑性水平是小胶质细胞发挥各种功能所必需的。转化能力使小胶质细胞有别于巨噬细胞,巨噬细胞必须定期更换,并且使小胶质细胞能够在极短的时间内保护中枢神经系统,而不会引起免疫紊乱。小胶质细胞会根据检测到的局部条件和化学信号,采用特定的形式或表型。
分枝
这种形式的小胶质细胞通常存在于整个大脑和脊髓的特定位置,没有异物或死亡细胞。这种“静止”形式的小胶质细胞由长分支过程和小细胞体组成。与变形虫形式的小胶质细胞不同,分支形式的细胞体保持原位,而其分支不断移动并勘察周围区域。分支对生理条件的微小变化非常敏感,需要非常特殊的培养条件才能在体外观察。与活化或变形小胶质细胞不同,分枝小胶质细胞不会吞噬细胞,并且分泌的免疫分子较少(包括MHC I / II类蛋白)。处于这种状态的小胶质细胞能够搜索和识别免疫威胁,同时保持中枢神经系统稳态。虽然这被认为是静止状态,但这种形式的小胶质细胞在化学探测环境中仍然非常活跃。分枝小胶质细胞可以随时转变为活化形式,以应对伤害或威胁。
反应性(活性)
尽管历史上经常使用“活化”小胶质细胞这一术语,但应将其替换为“反应性”小胶质细胞。事实上,表面上静止的小胶质细胞并非没有活性功能,“活化”一词具有误导性,因为它往往表示细胞反应性的“全有或全无”极化。在反应性小胶质细胞中上调的标志物Iba1经常用于可视化这些细胞。
非吞噬性
这种状态实际上是小胶质细胞从其分支形式转变为完全活跃的吞噬形式时逐渐出现的反应的一部分。小胶质细胞可以被多种因素激活,包括:促炎细胞因子、细胞坏死因子、脂多糖和细胞外钾的变化(表明细胞破裂)。一旦被激活,细胞就会发生几种关键的形态变化,包括分支增厚和收缩、MHC I/II 类蛋白的吸收、免疫分子的表达、细胞毒性因子的分泌、募集分子的分泌和促炎信号分子的分泌(导致促炎信号级联)。激活的非吞噬性小胶质细胞通常表现为“浓密”、“杆状”或小变形虫,具体取决于它们在分支到完全吞噬转化过程中的距离。此外,小胶质细胞也会快速增殖以增加其数量。从严格的形态学角度来看,小胶质细胞形态沿连续体的变化与形态复杂性的变化有关,可以用分形分析方法进行量化,这种方法已被证明对不同病理状态下不同形态相关的细微的、视觉上无法察觉的变化很敏感。
吞噬作用
活化吞噬性小胶质细胞是免疫反应最强的小胶质细胞。这些细胞通常呈大型变形虫状,尽管也观察到了一些差异。除了具有活化非吞噬性小胶质细胞的抗原呈递、细胞毒性和炎症介导信号传导外,它们还能够吞噬异物并展示由此产生的免疫分子以激活T 细胞。吞噬性小胶质细胞会前往受伤部位,吞噬有害物质,并分泌促炎因子以促进更多细胞增殖并产生相同的作用。活化吞噬性小胶质细胞还会与星形胶质细胞和神经细胞相互作用,以尽快抵抗任何感染或炎症,同时尽量减少对健康脑细胞的损害。
变形性
这种形状使小胶质细胞能够在整个神经组织中自由移动,从而使其能够发挥其作为清道夫细胞的作用。变形虫小胶质细胞能够吞噬碎片,但不能发挥与活化小胶质细胞相同的抗原呈递和炎症作用。变形虫小胶质细胞在大脑发育和重新布线期间尤其普遍,此时有大量细胞外碎片和凋亡细胞需要清除。这种形式的小胶质细胞主要存在于胼胝体中被称为“小胶质细胞喷泉”的围产期白质区域内。
Gitter细胞
Gitter细胞是小胶质细胞吞噬感染性物质或细胞碎片的最终结果。最终,在吞噬一定量的物质后,吞噬性小胶质细胞将无法再吞噬任何物质。由此产生的细胞团被称为颗粒小体,因其“颗粒状”外观而得名。通过观察染色的组织以显示颗粒细胞,病理学家可以看到感染后的愈合区域。
功能
通过嘌呤信号激活小胶质细胞小胶质细胞在中枢神经系统内执行各种不同的任务,主要与免疫反应和维持体内平衡有关。以下是这些细胞执行的一些主要已知功能。[需要引证]
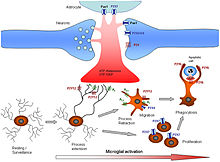
通过嘌呤信号激活小胶质细胞
拾荒
除了对环境中的细微变化非常敏感之外,每个小胶质细胞还会定期物理勘察其区域。此动作在变形虫状态和静息状态下进行。当小胶质细胞在其设定区域移动时,如果发现任何异物、受损细胞、凋亡细胞、神经原纤维缠结、DNA 片段或斑块,它就会激活并吞噬这些物质或细胞。以这种方式,小胶质细胞还充当“管家”,清理随机的细胞碎片。在大脑发育过程中,小胶质细胞在调节神经前体细胞数量和清除凋亡神经元方面发挥着重要作用。还有证据表明,小胶质细胞可以通过吞噬和消除突触来改善突触回路。发育后,大多数死亡或凋亡的细胞存在于大脑皮层和皮层下白质中。这也许可以解释为什么大多数变形虫小胶质细胞都存在于大脑皮层的“小胶质细胞喷泉”中。
吞噬作用
小胶质细胞的主要作用是吞噬,吞噬各种物质。吞噬的物质通常包括非发炎状态下的细胞碎片、脂质和凋亡细胞,以及发炎状态下的入侵病毒、细菌或其他外来物质。一旦小胶质细胞“吃饱”,它就会停止吞噬活动,变成相对不活跃的胶质细胞。
细胞外信号
小胶质细胞在大脑中的作用主要是维持未感染区域的体内平衡并促进受感染或受损组织的炎症。小胶质细胞通过一系列极其复杂的细胞外信号分子实现这一目标,这些分子使它们能够与其他小胶质细胞、星形胶质细胞、神经、T 细胞和髓系祖细胞进行交流。如上所述,细胞因子IFN-γ 可用于激活小胶质细胞。此外,在被 IFN-γ 激活后,小胶质细胞还会向细胞外空间释放更多的 IFN-γ。这会激活更多的小胶质细胞并启动细胞因子诱导的激活级联,迅速激活所有附近的小胶质细胞。小胶质细胞产生的 TNF-α 会导致神经组织凋亡并增加炎症。IL -8促进B 细胞生长和分化,从而帮助小胶质细胞抵抗感染。另一种细胞因子IL-1可抑制细胞因子IL-10和TGF-β,从而下调抗原呈递和促炎信号传导。通过小胶质细胞产生趋化分子(如MDC、IL-8 和MIP-3β ),额外的树突状细胞和 T 细胞被募集到损伤部位。最后,PGE 2和其他前列腺素类物质通过抑制小胶质细胞促炎反应和下调Th1(T 辅助细胞)反应来预防慢性炎症。
抗原呈递
如上所述,由于缺乏 MHC I/II 类蛋白,常驻非活化小胶质细胞作为抗原呈递细胞的能力较差。活化后,它们迅速表达 MHC I/II 类蛋白,并迅速成为有效的抗原呈递者。在某些情况下,小胶质细胞也可被 IFN-γ 激活以呈递抗原,但其功能不如被 MHC I/II 类蛋白摄取时那么有效。在炎症期间,T 细胞借助特殊的表面标志物穿过血脑屏障,然后直接与小胶质细胞结合以接收抗原。一旦被呈递抗原,T 细胞就会继续发挥多种作用,包括促炎募集、免疫记忆形成、细胞毒性物质分泌以及直接攻击外来细胞的质膜。
细胞毒性
小胶质细胞除了能够通过吞噬作用通过细胞间接触消灭传染性生物外,还能释放多种细胞毒性物质。培养的小胶质细胞会分泌大量的过氧化氢和一氧化氮,这一过程被称为“呼吸爆发”。这两种化学物质都会直接损害细胞,导致神经元细胞死亡。小胶质细胞分泌的蛋白酶会分解特定蛋白质,造成直接细胞损伤,而IL-1等细胞因子会促进神经元轴突脱髓鞘。最后,小胶质细胞可以通过分泌谷氨酸、天冬氨酸和喹啉酸,通过 NMDA 受体介导的过程损伤神经元。细胞毒性分泌旨在摧毁受感染的神经元、病毒和细菌,但也会造成大量的附带神经损伤。因此,慢性炎症反应会导致大规模神经损伤,因为小胶质细胞会破坏大脑,试图摧毁入侵的感染。依达拉奉是一种自由基清除剂,能消除由活化的小胶质细胞引起的氧化神经毒性。
突触剥离
1968 年,布林辛格和克鲁兹伯格首次在脊髓损伤中发现了一种现象,炎症后小胶质细胞会从受损组织附近的神经中移除分支。这有助于促进受损神经回路的再生和重新映射。研究还表明,小胶质细胞参与了大脑发育过程中的突触修剪过程。
促进修復
炎症后,小胶质细胞会经历几个步骤来促进神经组织的再生。这些步骤包括突触剥离、抗炎细胞因子的分泌、将神经元和星形胶质细胞募集到受损区域以及形成胶质细胞。如果没有小胶质细胞,中枢神经系统常驻区域的再生和重新映射会慢得多,而大脑和眼睛周围的许多血管系统则几乎不可能再生和重新映射。最近的研究证实,小胶质细胞过程通过专门的躯体连接不断监测神经元功能,并感知神经细胞的“健康状况”。通过这种细胞间通讯途径,小胶质细胞能够发挥强大的神经保护作用,对脑损伤后的修复做出重大贡献。小胶质细胞还被证明通过接触未成熟的发育中的神经元来促进大脑的正常发育。
发展
中枢神经系统小胶质细胞的起源和出现。长期以来,人们认为小胶质细胞是在骨髓中从造血干细胞(所有血细胞的祖细胞)分化而来的。然而,最近的研究表明,小胶质细胞起源于一个极其有限的胚胎期的卵黄囊,并在一个精确协调的分子过程的引导下进入脑实质。 卵黄囊祖细胞需要激活集落刺激因子 1 受体(CSF1R) 才能迁移到脑中并分化为小胶质细胞。此外,小胶质细胞重新繁殖的最大贡献是基于其局部自我更新,无论是在稳定状态还是疾病状态下,而循环单核细胞也可能有较小程度的贡献,尤其是在疾病状态下。单核细胞还可以分化为外周系统中的髓系树突状细胞和巨噬细胞。与身体其他部位的巨噬细胞一样,小胶质细胞使用吞噬和细胞毒性机制来破坏异物。小胶质细胞和巨噬细胞都通过充当抗原呈递细胞来促进免疫反应,并通过分泌细胞因子和其他信号分子来促进体内的炎症和稳态机制。在下调形式中,小胶质细胞缺乏MHC I 类/ MHC II 类蛋白、IFN-γ细胞因子、CD45 抗原和许多其他表面受体,而这些受体是正常巨噬细胞所特有的抗原呈递、吞噬和细胞毒性作用所必需的。小胶质细胞与巨噬细胞的不同之处还在于,它们在空间和时间上受到更严格的调控,以维持精确的免疫反应。
小胶质细胞与从髓系祖细胞分化而来的其他细胞之间的另一个区别是周转率。巨噬细胞和树突状细胞不断被消耗,并被分化成所需类型的髓系祖细胞所取代。由于血脑屏障的存在,身体很难不断更换小胶质细胞。因此,小胶质细胞不会不断被髓系祖细胞所取代,而是在静止状态下保持现状,然后当它们被激活时,它们会迅速增殖以保持其数量。然而,骨嵌合体研究表明,在极度感染的情况下,血脑屏障会变弱,小胶质细胞将被造血、骨髓衍生的细胞(即髓系祖细胞和巨噬细胞)所取代。一旦感染减少,外周系统和中枢系统之间的断开就会重新建立,在恢复和再生期间只有小胶质细胞存在。
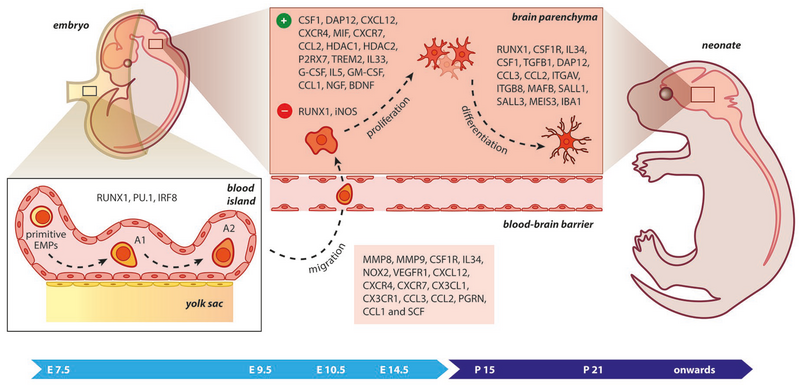
中枢神经系统小胶质细胞的起源和出现
老化
小胶质细胞在损伤期间会经历一阵有丝分裂活动;这种增殖之后是细胞凋亡,使细胞数量减少到基线水平。小胶质细胞的激活会给细胞的合成代谢和分解代谢机制带来负担,导致激活的小胶质细胞比未激活的细胞更快死亡。为了补偿随着时间的推移小胶质细胞的损失,小胶质细胞会经历有丝分裂,骨髓衍生的祖细胞会通过脑膜和脉管系统迁移到脑中。
正常衰老过程中发生的轻微神经元损伤的积累会使小胶质细胞转化为增大且活跃的细胞。 这些与年龄相关的慢性小胶质细胞活化和 IL-1 表达增加可能会通过促进易感患者神经斑块的形成而增加患阿尔茨海默病的风险。 DNA 损伤可能导致与年龄相关的小胶质细胞活化。另一个因素可能是晚期糖基化终产物 的积累,它会随着年龄的增长而积累。这些蛋白质对蛋白水解过程具有很强的抵抗力,并促进蛋白质交联。
研究发现了营养不良(发育缺陷)的人类小胶质细胞。“这些细胞的特征是细胞质结构异常,例如脱枝、萎缩、碎裂或异常曲折的突起,经常带有球状或球状肿胀。” 营养不良性小胶质细胞的发病率会随着年龄的增长而增加。在对朊病毒病、精神分裂症和阿尔茨海默病 的研究中,已经报告了小胶质细胞的退化和死亡,这表明小胶质细胞的退化可能与神经退行性疾病有关。这一理论的一个复杂之处在于,很难区分人类大脑中“激活”和“营养不良”的小胶质细胞。
小鼠实验表明,CD22 阻断可恢复衰老大脑中稳态的小胶质细胞吞噬功能。
临床意义
小胶质细胞在疾病中的作用
小胶质细胞是中枢神经系统的主要免疫细胞,类似于外周巨噬细胞。它们通过改变形态并迁移到感染/受伤部位来应对病原体和损伤,在那里它们会破坏病原体并清除受损细胞。作为其反应的一部分,它们会分泌细胞因子、趋化因子、前列腺素和活性氧,帮助引导免疫反应。此外,它们还通过产生抗炎细胞因子,有助于缓解炎症反应。小胶质细胞还因其在神经退行性疾病(如阿尔茨海默病、帕金森病、多发性硬化症)以及心脏病、青光眼、病毒和细菌感染中的有害作用而受到广泛研究。越来越多的证据表明,免疫失调是导致强迫症 (OCD)、图雷特综合症和与链球菌感染相关的儿童自身免疫性神经精神疾病 (PANDAS)的病理生理学因素。
由于小胶质细胞对中枢神经系统稳态的细微变化反应迅速,因此它们可被视为神经功能障碍或疾病的传感器。如果出现脑病变,小胶质细胞表型肯定会改变。因此,分析小胶质细胞可以成为诊断和描述任何给定组织样本中中枢神经系统疾病的灵敏工具。特别是,应评估小胶质细胞密度、细胞形状、分布模式、不同的小胶质细胞表型以及与其他细胞类型的相互作用。
感體遗传學
小胶质细胞感觉体是一个相对较新的生物学概念,似乎在神经发育和神经退行性中发挥着重要作用。感觉体是指用于感知配体和微生物的独特蛋白质转录本分组。换句话说,感觉体代表了用于感知体内分子的蛋白质所需的基因。可以使用多种方法来分析感觉体,包括qPCR、RNA 测序、微阵列分析和直接 RNA 测序。感觉体中包含的基因编码质膜上的受体和跨膜蛋白,与神经元相比,它们在小胶质细胞中的表达更高。它不包括分泌蛋白或特定于膜结合细胞器(如细胞核、线粒体和内质网)的跨膜蛋白。已鉴定的多个感觉体基因编码模式识别受体,但其中包含的基因种类繁多。小胶质细胞与其他巨噬细胞具有相似的传感体,但它们含有 22 个独特基因,其中 16 个用于与内源性配体相互作用。这些差异产生了一种独特的小胶质细胞生物标记物,其中包括 40 多个基因,包括P2ry12和HEXB。DAP12 ( TYROBP ) 似乎在传感体蛋白质相互作用中发挥重要作用,充当信号转导接头和调节蛋白。感觉体中的基因调控必须能够改变,以应对潜在的危害。为了应对这些危险,小胶质细胞可以发挥神经保护或神经毒性的作用。 出于这些原因,人们怀疑感觉体可能在神经退行性疾病中发挥作用。随着衰老而上调的感觉体基因主要参与感知感染性微生物配体,而下调的感觉体基因主要参与感知内源性配体。这项分析表明,在自然神经退行性疾病中,神经胶质细胞特异性调控有利于神经保护。这与神经退行性疾病中出现的神经毒性转变形成对比。
感觉体还可以在神经发育中发挥作用。早期脑部感染会导致小胶质细胞对后来的免疫刺激过度敏感。暴露于感染时,与神经炎症有关的感觉体基因会上调,而与神经可塑性有关的基因会下调。然而,感觉体改变神经发育的能力也许能够对抗疾病。在Rett 综合征的啮齿动物模型中,删除高表达的感觉体基因CX3CL1可改善健康状况并延长寿命。在没有 Rett 综合征的人类中,Cx 3 cr1的下调与类似于精神分裂症的症状有关。这表明,感觉体不仅在各种发育障碍中发挥作用,而且需要严格调节才能维持无病状态。
热门产品推荐
-

HELA人宫颈癌细胞(STR鉴定正确)
¥1200元
-
HSF人皮肤成纤维细胞(免疫荧光鉴定)
¥1800元
-

Bel-7405人肝癌细胞(STR鉴定正确)
¥1200元
-

Hep G2人肝癌细胞(STR鉴定正确)
¥1200元
-

A549人非小细胞肺癌细胞(STR鉴定正确)
¥1200元
-
H9C2大鼠心肌细胞(种属鉴定正确)
¥1200元
大家都在看
-
hiPSC人诱导多能干细胞培养教程:在培养hiPSC细胞前,需准备好hESC/iPSC完全培养基配制和Matrigel铺板,hiPSC人诱导多能干细胞复苏操作,1. 将水浴锅预热至37℃;并将Matrigel包被的6孔板,提前放置生物安全柜中约1小时恢复···...
阅读详情 -
H9人胚胎干细胞培养条件与方法:1. 将水浴锅预热至37℃,并将Matrigel包被的6孔板,提前放置生物安全柜中约1小时恢复至室温(15~30℃);2. 取4 mL hESC/iPSC完全培养基,按照1:4000比例加入1 μL的hESC/iPSC Supplement C,···...
阅读详情 -
H1人胚胎干细胞培养指南:在培养h1干细胞之前,首先要准备好hESC/iPSC完全培养基配制, 铺板,H1人胚胎干细胞复苏步骤:1.将水浴锅预热至37℃;并将Matrigel包被的6孔板,提前放置生物安全柜中约1小时恢复至室温(15~30℃);···...
阅读详情 -
4T1细胞培养方法:小鼠乳腺癌4T1细胞培养基 90%DMEM+10% FBS+PS,生长条件:气相:95%空气+5%二氧化碳;温度:37℃,4T1细胞形态特征为上皮细胞样,贴壁生长,如果4T1细胞密度达80%-90%,即可进行传代培养,传代方法:1:2至1:3···...
阅读详情 -
常用人肝癌细胞系有哪些及如何选择:目前较为常用的几株人肝癌细胞系SMMC-7721、Bel-7402、MHCC97、HepG2、Hep3B、Huh-7 and PLC/PRF/5,那么人肝癌细胞株如何选择呢?一方面你可以查找相关的文献,另一方面可以考虑选择···...
阅读详情 -
HL-60细胞生长慢解决方法及如何养好:当HL-60细胞传代后生长速度慢且状态不佳时,可竖着培养直到培养基变黄,待细胞密度起来后,状态会有所好转,同时,若HL-60细胞状态很差,可采用半换液的方式:以T25瓶子为例,瓶子里有5m···...
阅读详情
- 上一篇:神经干细胞( NSC )
- 下一篇:少突胶质细胞(Oligodendrocyte)







